藥華藥第二季本業獲利年增147% EPS2.5元 未來營運一次看清楚
財經中心/綜合報導
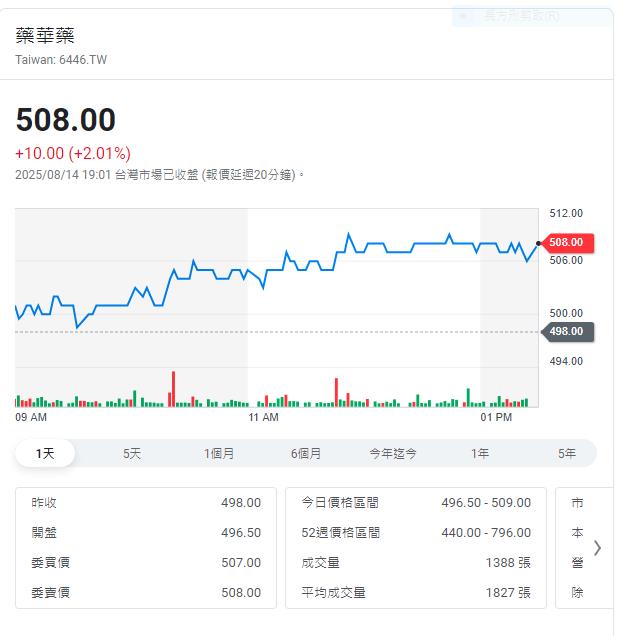
藥華藥(6446)治真性紅血球增多症(PV)新藥Ropeg全球銷售持續成長,第二季營收達36.0億元,季增10.60%,年增56.19%,自2023年第二季起已連續九季度創新高,第二季本業獲利年增147.57%,每股盈餘(EPS)2.5元。經營團隊今(14)日受邀參加法說會指出,下半年營收有望續逐季攀升。今天股價上漲10元,來到508元。

藥華藥上半年累計營收達68.6億元,年增73.23%;本業獲利達22.0億元,年增378.31%;淨利達21.0億元,年增107.46%;EPS達6.30元,三大重要財務指標均大幅躍升、創下歷史新高,充分突顯新藥公司業績的爆發力,以及高獲利能力。
公司營收與獲利均維持強勁成長,並持續保持高毛利率。以目前趨勢,營收有望持續維持逐季成長。第二季營業費用係因計畫性分別擴編美國銷售團隊65%和日本銷售團隊45%而增加,仍遠低於營收年增幅度,本業獲利強勁放大,第二季單季本業獲利11.0億元,年增近1.5倍;上半年本業獲利22.0億元,較去年同期更大增近4倍,已賺逾半個股本。藥華藥表示,公司將持續加速營運成長曲線,再配合適度控管營運支出,在費用控管得當且銷售能力提升下,預期下半年獲利動能將持續增強。
藥華藥本月5日公布7月單月營收突破13.0億元,月增8.76%、年增48.01%,創單月歷史新高。今年累計至7月營收已達81.6億元,年增68.65%。
近期營運重點
●完成美日行銷業務團隊擴編,「全通路」策略加速推升Ropeg銷售創高
藥華藥第二季在美國與日本兩大核心市場完成計畫性行銷與業務團隊擴編,美國團隊規模較第一季提升65%、日本提升45%。公司持續推進全通路行銷(Omnichannel)策略,這個策略涵蓋電子郵件、簡訊、行動應用程式、社群媒體及即時對話工具,在執行面推行加強全方位溝通渠道的整合,全面提升市場推廣、醫師教育與人員訓練效率,並帶動銷售動能持續攀升。
美國市場第二季營運較第一季成長加速,Ropeg出貨數量持續創新高。今年6月,為讓醫學科學訊息傳遞(Medical messaging)更聚焦、簡潔且具影響力,公司於美國芝加哥舉辦全球醫療(Medical)、行銷(Marketing)與市場准入(Market access)會議(Global 3M meeting),與全球團隊及合作夥伴,如加拿大的FORUS Therapeutics Inc.(簡稱FORUS)和拉丁美洲的Pint-Pharma GmbH(簡稱Pint),統一策略,極為成功。
藥華藥旗下治療真性紅血球增多症(PV)新藥Ropeg已獲近50國核准並上市,持續擴大拓展全球市場。藥華藥表示,Ropeg新取得阿根廷藥證、並送件申請越南、加拿大藥證,也預計盡快取得墨西哥藥證;同時,Ropeg納入加拿大「專案核准進口與銷售藥品清單」後,出貨挹注營收,未來將拓展更多此類銷售機會。藥華藥並於日本申請仿單變更為高劑量方案,可望提升出貨量,帶動銷售成長,而於韓國則可望今年第三季納入健保。
●新適應症原發性血小板過多症(ET)目標2026取證 ,有望成營運第二成長引擎
藥華藥持續推進Ropeg用於新適應症原發性血小板過多症(ET)的全球藥證申請,目標於2026年陸續取得各市場核准,目前已同步積極規劃並啟動投入商業化準備,涵蓋銷售、行銷及市場准入策略布局,屆時有望成為推動營運的第二成長引擎。
中國國家藥品監督管理局(NMPA)於7月16日正式受理ET藥證申請,NMPA已請公司提供進一步資訊以利審查。美國市場方面,藥華藥已獲美國食品藥品監督管理局(FDA)通知於今年9月召開藥證送件前(Pre-BLA)會議,若推展順利,預計於今年底前完成送件程序。公司也已規畫今年盡快向臺灣、日本提出ET藥證申請。
Ropeg用於ET的全球第三期臨床試驗SURPASS ET研究成果正面,顯示Ropeg組在持久臨床反應率方面明顯優於使用Anagrelide的對照組(42.9% vs. 6.0%;p=0.0001),達到統計上顯著意義。該研究成果於2025年美國臨床腫瘤學會(ASCO)年會中進行口頭報告,榮獲「Best of ASCO」年度精選論文肯定,並入選歐洲血液學協會(EHA)年會六大頂尖摘要之一,於最高榮譽的主會場(Plenary Session)發表,令醫師們印象極為深刻。兩大國際年會的高度肯定,使SURPASS ET試驗受到全球學術界與骨髓增生性腫瘤(MPN)醫療社群的廣泛關注與積極迴響。
藥華藥亦已向美國國家綜合癌症資訊網(NCCN)提出申請,請求將Ropeg納入NCCN治療指南中針對ET患者的推薦治療選項,預計最快可於今年內納入。NCCN指南為美國保險給付的重要依據,若提前納入,即便尚未獲得FDA核准,仍可能促成特例支付、仿單外(off-label)使用或醫院採購,提升臨床可及性與覆蓋率;並有助於藥證審查加速,正面影響未來在美國ET市場的保險與給付策略,並為國際醫療科技評估(HTA)提供臨床價值的佐證。
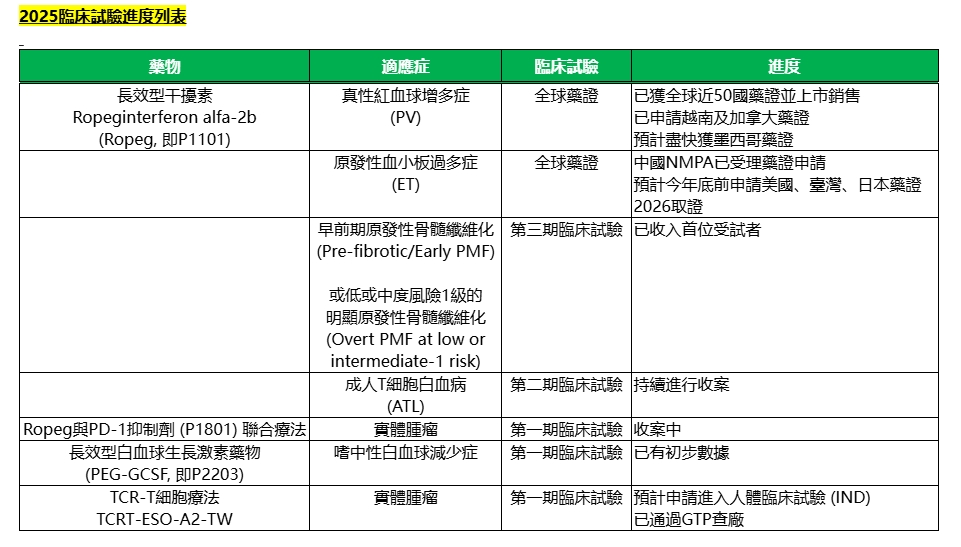
展望未來,藥華藥表示,將持續增加Ropeg新適應症,其中,原發性骨髓纖維化(PMF)方面,首位受試者已給藥,公司同時也與全球頂尖醫學中心合作進行多項主持人發起之臨床試驗(IIT),包含皮膚性T細胞淋巴瘤(CTCL)、慢性骨髓性白血病(CML)等。藥華藥也擴展應用PEGylation平台發展新藥,加速進入人體試驗,並發展頂級的研發平台,開發「同類首創」(FiC)與「同類最優」(BiC)新藥。
美國近期通過「大而美法案」(One Big Beautiful Bill Act, OBBBA),藥華藥表示,此次稅改對公司美國子公司營運具有正面影響,包含美國境內研發支出可全數認列為當年度稅務費用抵減課稅所得(原先應於5年內攤銷)、恢復製造用設備與廠房的100%獎勵性折舊攤提,以及提高利息費用認列上限等措施,均有助於降低營運成本、提升資金運用彈性。將與會計師合作,評估美國兩家子公司可適用的稅改範圍並辦理相關稅務申報,以有效節省稅務支出。




